细胞凋亡检测
细胞凋亡,或称程序性细胞死亡,是维持机体稳态、清除异常或多余细胞的关键生理过程。在生物医学研究中,准确检测和定量凋亡细胞至关重要。流式细胞术凭借其高通量、多参数、定量的优势,成为检测细胞凋亡的金标准方法。其中最常用、最经典的技术就是 Annexin V 结合 / 碘化丙啶(PI)双染法。
01、核心原理
Annexin V:识别早期凋亡细胞。在凋亡早期,细胞膜磷脂酰丝氨酸(PS)会从细胞膜内侧翻转到外侧(这是重要的“吃我”信号)。Annexin V 是一种钙离子依赖的磷脂结合蛋白,对 PS 具有高亲和力。它能特异性结合暴露在细胞膜外侧的 PS,标记早期凋亡细胞。
碘化丙啶(PI):识别晚期凋亡和坏死细胞。PI 是一种核酸染料,不能透过完整的细胞膜。只有当细胞膜完整性丧失(晚期凋亡或坏死)时,PI 才能进入细胞,与 DNA/RNA 结合发出荧光。活细胞和早期凋亡细胞(膜完整)拒染 PI。
通过同时检测 Annexin V 和 PI 的信号,我们可以将细胞群体精确地区分为四类:
Annexin V⁻ / PI⁺:坏死细胞(膜完整性丧失,但PS未外翻或已降解)
Annexin V⁺ / PI⁺:晚期凋亡细胞(膜PS外翻,膜完整性丧失)
Annexin V⁻ / PI⁻:活细胞(正常/未凋亡)
Annexin V⁺ / PI⁻:早期凋亡细胞(膜PS外翻,膜完整)
02、实验步骤(Annexin V/PI 双染法 - 以贴壁细胞为例)
试剂与耗材
- 细胞样本(处理组和对照组)
- 1x Annexin V 结合缓冲液(通常由试剂盒提供或自配:10mM HEPES, 140mM NaCl, 2.5mM CaCl₂, pH 7.4)
- FITC(或其他荧光素)标记的 Annexin V
- 碘化丙啶(PI)溶液(工作浓度通常为 1-5 μg/mL)
- PBS(无钙镁)
- 胰酶(不含EDTA或含低浓度EDTA)或温和细胞刮刀
- 流式管
- 离心机
- 冰
- 移液器及枪头
操作流程
细胞准备与处理:
将细胞接种于培养板/皿中,生长至合适密度。
施加凋亡诱导因素(如药物、射线、饥饿等)或对照处理。注意:根据实验目的优化处理时间(通常几小时到几十小时),以获得合适的凋亡比例。
关键点:处理时间结束时,确保收集足够数量的细胞(通常 ≥ 106 个/样本)。
细胞收集:
贴壁细胞:
- 轻柔吸弃培养液。避免直接冲击细胞!
- 用预冷的 PBS 轻轻洗涤细胞 1-2 次。
- 方法一(推荐):加入适量不含EDTA或含低浓度EDTA的胰酶(如Accutase)消化,时间尽量短(通常30秒-1分钟),待细胞刚刚开始变圆松动时,立即加入含血清的培养基终止消化。轻柔吹打收集细胞。(避免过度消化损伤细胞膜)
- 方法二:用预冷的 PBS 洗涤后,直接用预冷的细胞刮刀轻柔刮下细胞,收集到离心管中。(物理方法可能增加机械损伤)
悬浮细胞:直接离心收集细胞(通常 300g, 5分钟),弃上清。
洗涤:
用预冷的 PBS 轻柔重悬细胞。
离心(300g, 5分钟),弃上清。重复洗涤一次。(去除残留培养基和血清)
重悬于结合缓冲液:
用适量的 1x Annexin V 结合缓冲液(通常100-500μL)轻柔重悬细胞沉淀,制备成单细胞悬液。避免剧烈吹打产生气泡!
将细胞悬液转移到流式管中。
Annexin V 染色:
根据试剂说明书推荐量(通常每 10⁵-10⁶ 个细胞加 1-5μL),加入 FITC-Annexin V(或其他荧光素标记的 Annexin V)。注意避光操作。
轻柔混匀。
冰上避光孵育 10-15分钟。(低温减少细胞状态变化,避光防止荧光淬灭)
PI 染色(可选,但强烈推荐双染):
孵育结束前 5 分钟或孵育结束时,加入 PI 溶液(终浓度通常 1-5 μg/mL)。注意避光操作。
轻柔混匀。
如果只加PI,则立即上机检测;如果同时加了Annexin V和PI,可继续冰上避光放置≤5分钟(或按说明书要求)。
上机检测:
在染色完成后 1 小时内完成流式检测!(时间过长会影响结果准确性)
无需洗涤(避免损失结合的Annexin V或细胞)。
立即将样品置于流式细胞仪上机检测。注意避光。
关键点:设置合适的电压和补偿。通常需要:
- FSC/SSC 散点图:圈门排除碎片和粘连细胞(选择目标细胞群)。
- FITC-Annexin V 通道(如 FL1) vs PI 通道(如 FL2 或 FL3)的散点图或密度图。
- 未染色细胞:设置电压和调节荧光背景。
- 单染 FITC-Annexin V 细胞(不加PI):用于调节 FL1 对 FL2/FL3 的补偿(补偿掉 FITC 荧光在 PI 通道的渗漏)。
- 单染 PI 细胞(不加 Annexin V):用于调节 FL2/FL3 对 FL1 的补偿(补偿掉 PI 荧光在 FITC 通道的渗漏)。
03、结果解读
流式细胞仪分析软件(如 FlowJo, FCS Express, BD FACSDiva 等)会生成关键的双参数散点图或密度图:X轴通常是 Annexin V 荧光强度(如 FITC),Y轴是 PI 荧光强度。
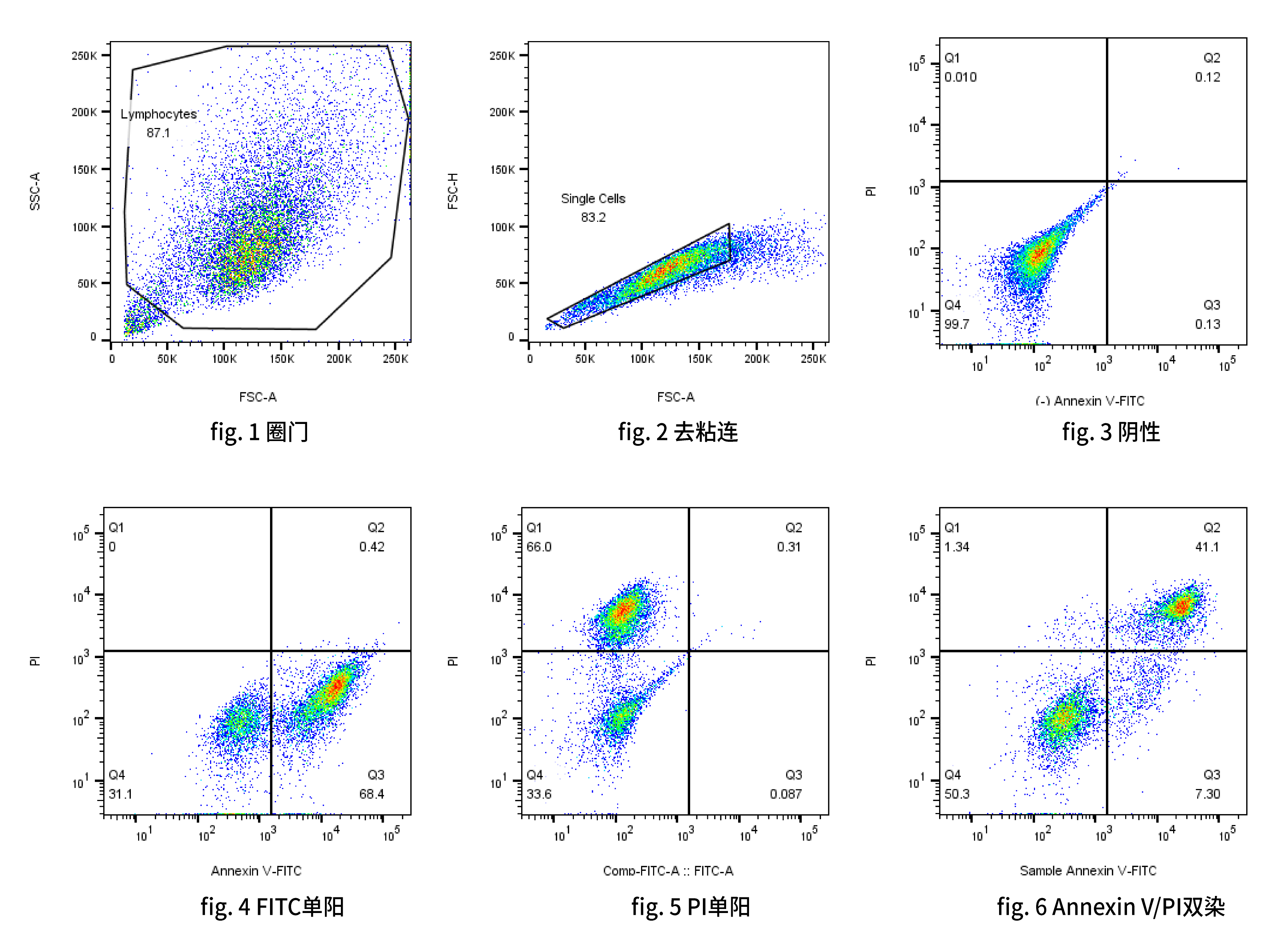
象限划分
左下象限 (Q4: Annexin V⁻ / PI⁻):活细胞。细胞未被染色或仅有很低的自发荧光。
右下象限 (Q3: Annexin V⁺ / PI⁻):早期凋亡细胞。Annexin V 阳性(结合了暴露的PS),PI 阴性(膜完整)。
右上象限 (Q2: Annexin V⁺ / PI⁺):晚期凋亡细胞或坏死细胞。Annexin V 阳性,PI 阳性(膜完整性丧失)。在标准的凋亡进程中,这些细胞通常由早期凋亡发展而来(继发性坏死)。
左上象限 (Q1: Annexin V⁻ / PI⁺):坏死细胞或机械损伤细胞。Annexin V 阴性(PS未暴露或已降解),PI 阳性(膜完整性严重破坏)。如果实验操作非常小心,这个象限的细胞比例应该很低;高比例可能提示样本处理不当(如过度消化或吹打)或样本本身包含大量原发坏死细胞。
关键参数与报告:
总凋亡率:Q3%(早期凋亡)+ Q2%(晚期凋亡)
早期凋亡率:Q3%(早期凋亡)
晚期凋亡/坏死率:Q2%(晚期凋亡)
坏死/损伤率:Q1%(坏死)
存活率:Q4%(活细胞)
解读示例:
对照组:Q4(活细胞)占绝大多数,Q3(早期凋亡)和Q2(晚期凋亡)比例很低(通常<5-10%),Q1(坏死)非常低。
凋亡诱导组:
- 如果药物/处理主要诱导早期凋亡:Q3(早期凋亡)比例显著升高,Q2(晚期凋亡)可能略有升高,Q4(活细胞)降低。
- 如果处理时间较长或作用较强:Q2(晚期凋亡)比例显著升高,Q3(早期凋亡)可能仍然较高或开始下降(细胞进入晚期),Q4(活细胞)显著降低。
- 如果处理导致大量快速坏死:Q1(坏死)和Q2(晚期凋亡/坏死)比例显著升高,Q3(早期凋亡)可能不高。
比较不同处理组:计算并比较各组的总凋亡率(Q3+Q2)或早期/晚期凋亡率,结合统计学分析(如t检验、ANOVA),判断不同处理对细胞凋亡的影响是否具有显著性差异。
04、注意事项与优化技巧
样本新鲜度:处理后的细胞尽快检测(<1小时),避免放置过久导致自发凋亡增加或状态变化。
轻柔操作:所有步骤(收集、洗涤、重悬)务必轻柔,避免强力吹打或离心速度过高导致机械损伤(假阳性PI染色,误判为坏死)。
胰酶选择:贴壁细胞消化首选不含EDTA或含低浓度EDTA的温和消化酶(如Accutase),并严格控制消化时间。EDTA会螯合钙离子,而Annexin V结合PS需要钙离子!如果用含EDTA胰酶,必须彻底洗净EDTA(多洗几次)才能进行Annexin V染色。
钙离子依赖:Annexin V结合缓冲液必须含有足够浓度的Ca²⁺(通常2.5mM)。确保缓冲液新鲜配制或保存得当。
避光与低温:Annexin V 和 PI 染色及后续操作需在冰上避光进行,防止荧光淬灭和细胞状态变化。
浓度优化:不同细胞类型或不同批次的试剂,Annexin V 和 PI 的最佳工作浓度可能略有差异,建议预实验确定。
补偿调节:必须做!FITC和PI的荧光光谱有重叠,不做补偿或补偿不当会导致结果严重偏差(如早期凋亡细胞被误分到晚期凋亡象限)。
设置对照:必不可少!
- 未染色对照:设置细胞电压。
- 单染对照 (FITC-Annexin V only):调节补偿(FITC → PI通道)。
- 单染对照 (PI only):调节补偿(PI → FITC通道)。
- 生物学对照:未处理细胞(阴性对照),强凋亡诱导剂处理的细胞(阳性对照,如星形孢菌素STS)。
细胞浓度:上机时细胞浓度不宜过高或过低,避免堵塞管路或信号太弱。通常调整到事件率在1000-3000个细胞/秒左右。
数据分析:圈门策略要合理(先FSC/SSC排除碎片和粘连体),正确识别目标细胞群后再分析Annexin V/PI信号。注意区分真正的凋亡信号和背景噪音。
05、流式凋亡检测服务——代轩生物Annexin V/PI双染服务
✔ 金标准技术,精准解析凋亡全程
基于国际公认的Annexin V/PI双染法原理,严格区分:
- 活细胞 (Annexin V⁻/PI⁻):左下象限,活力基线;
- 早期凋亡细胞 (Annexin V⁺/PI⁻):右下象限,捕获PS外翻关键瞬间;
- 晚期凋亡/坏死细胞 (Annexin V⁺/PI⁺):右上象限,膜完整性丧失标志;
- 原发坏死/损伤细胞 (Annexin V⁻/PI⁺):左上象限,提示操作或样本问题。
>>> 独家优化Protocol,规避假阳性!严格把控胰酶消化时间(无EDTA酶)、钙离子浓度、避光染色与多重单染补偿对照,确保象限划分绝对准确。
✔ 专业平台,数据可靠无忧
高端仪器保障:采用主流流式细胞仪,确保检测灵敏度和稳定性。(流式细胞仪丨品牌:BD,型号:FACSLyric)
标准化质控:全程SOP操作,包含阴/阳性对照(如STS诱导凋亡细胞),数据可比性强。(凋亡检测试剂盒丨品牌:BD,货号:556547)
经验丰富的技术团队:多年专注细胞功能检测,累计处理样本超万例,疑难样本经验丰富。
✔ 极简流程,解放科研精力
您只需:
Step 1 提供样本:细胞株(贴壁/悬浮,≥1-2×10⁶个/样本)或抗凝全血(人/鼠/大鼠等)。
Step 2 告知处理:药物浓度、作用时间等关键信息(可签署保密协议)。
Step 3 坐收报告:剩余交给我们!
>>> 服务流程透明:细胞处理 → Annexin V/PI双标 → 流式上机 → 专业补偿调节 → 四象限分析。
✔ 专业报告,助力科研决策与发表
交付内容清晰详实,包含:
原始流式数据文件 (FCS格式):供您自行深度分析。
标准结果图:带十字门四象限散点图/密度图,直观展示细胞群分布。
关键定量分析:
- 活细胞率 (%,Q4 - Annexin V⁻/PI⁻)
- 早期凋亡率 (%,Q3 - Annexin V⁺/PI⁻)
- 晚期凋亡/坏死率 (%,Q2 - Annexin V⁺/PI⁺)
- 总凋亡率 (%,Q3+Q2,核心指标!)
- 坏死/损伤率 (%,Q1 - Annexin V⁻/PI⁺)
完整实验报告:详细步骤、试剂信息(厂家/货号/批号)、仪器参数,符合期刊发表要求。
✔ 高性价比与灵活服务
基础服务定价:仅 ¥100/管 起,批量更优!
加急通道可选:最快 48小时 交付结果。
配套服务:可提供细胞培养、凋亡诱导、TUNEL晚期凋亡检测等一站式方案。









