复旦团队发现:Foxp3经线粒体重编程CAR-T代谢,提升实体瘤治疗持久性
CAR-T疗法在血液瘤中效果显著,但受限于实体瘤的低糖、缺氧、高乳酸微环境,易致细胞能量枯竭与功能耗竭。调节性T细胞(Treg)因其脂代谢优势能在该环境中存活,提供了重要启示。
Foxp3是Treg的关键转录因子。复旦大学储以微、骆菲菲团队最新研究发现,Foxp3可通过非转录依赖的方式调控CAR-T细胞的线粒体动态,重塑其代谢表型(如增强脂代谢适应性),使其获得在实体瘤严苛微环境中的生存优势,从而显著提升治疗的持久性与有效性。该研究为突破实体瘤CAR-T治疗瓶颈提供了“增效减毒”的创新策略,成果发表在期刊《Cell Metabolism》上(IF=27.7)。
图片来源:www.cell.com
一、CAR-TFoxp3细胞获得了与CAR-TConv细胞不同的代谢特性
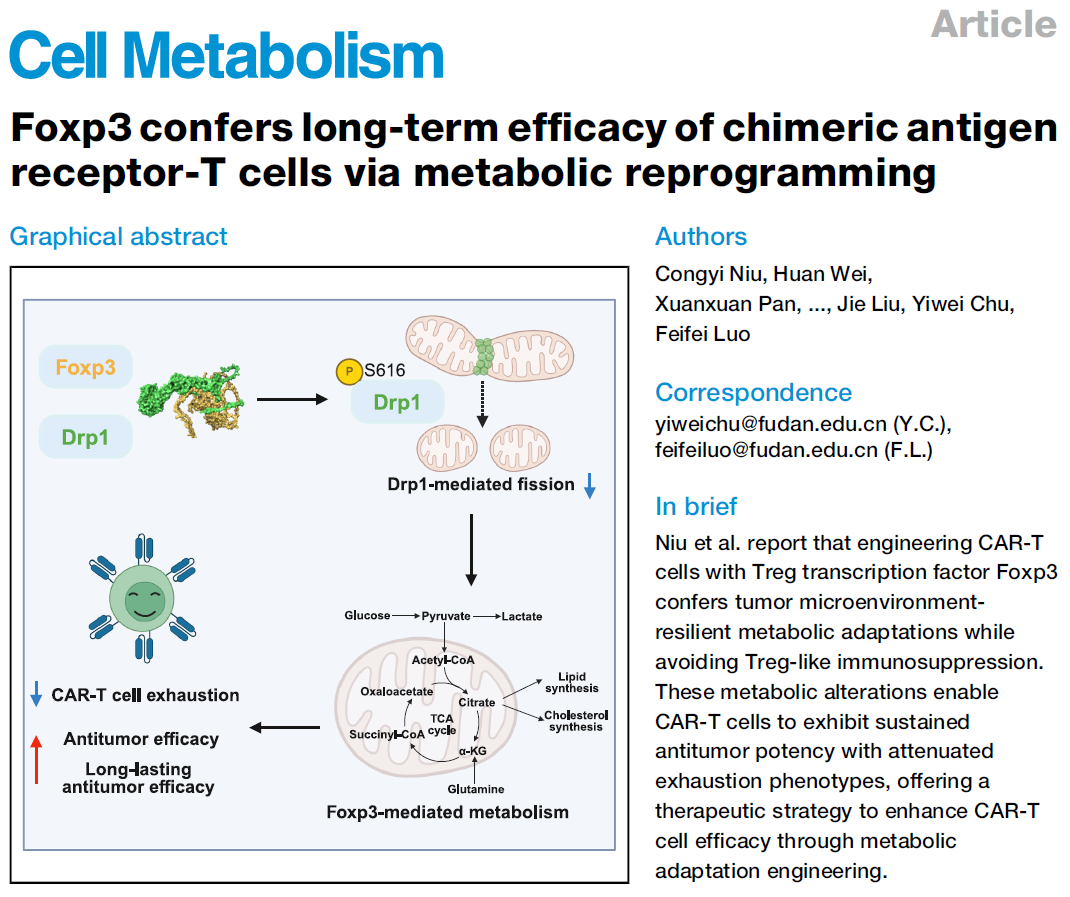
研究构建了共表达Foxp3和第三代CAR结构的CAR-TFoxp3细胞。抗原刺激下,CAR-TFoxp3细胞整体代谢活性降低,表现为糖酵解(ECAR)和氧化磷酸化(OCR)水平下降。代谢流分析显示其葡萄糖和谷氨酰胺利用减少,ATP水平降低,但NAD/NADH比值升高。
代谢组学揭示CAR-TFoxp3细胞脂质(甘油三酯、脂滴)和氨基酸代谢通路显著改变,呈现类似Treg的代谢特征。同时,其线粒体膜电位和质量下降。抑制OXPHOS的药物可逆转脂滴积聚,表明Foxp3通过抑制OXPHOS促进了脂质代谢活化。

图1. CAR-TFoxp3细胞获得了与 CAR-TConv细胞不同的代谢特性
二、Foxp3与Drp1结合决定CAR-T细胞的代谢特性
研究发现Foxp3特异性结合线粒体裂变关键蛋白Drp1(而非融合蛋白),并抑制Drp1第616位丝氨酸(Ser616)的磷酸化,导致CAR-TFoxp3细胞线粒体更融合、聚集且数量减少。
通过缺失突变体定位,确定Foxp3的第340-390氨基酸片段是结合Drp1(推测结合Drp1第600-620位)并抑制其Ser616磷酸化的关键区域。缺失此片段(CAR-TFoxp3 (340-390))的细胞恢复了线粒体数量、膜电位、糖酵解与OXPHOS能力以及正常脂滴水平,证明Foxp3通过结合并抑制Drp1活性来重塑线粒体动态和细胞代谢。
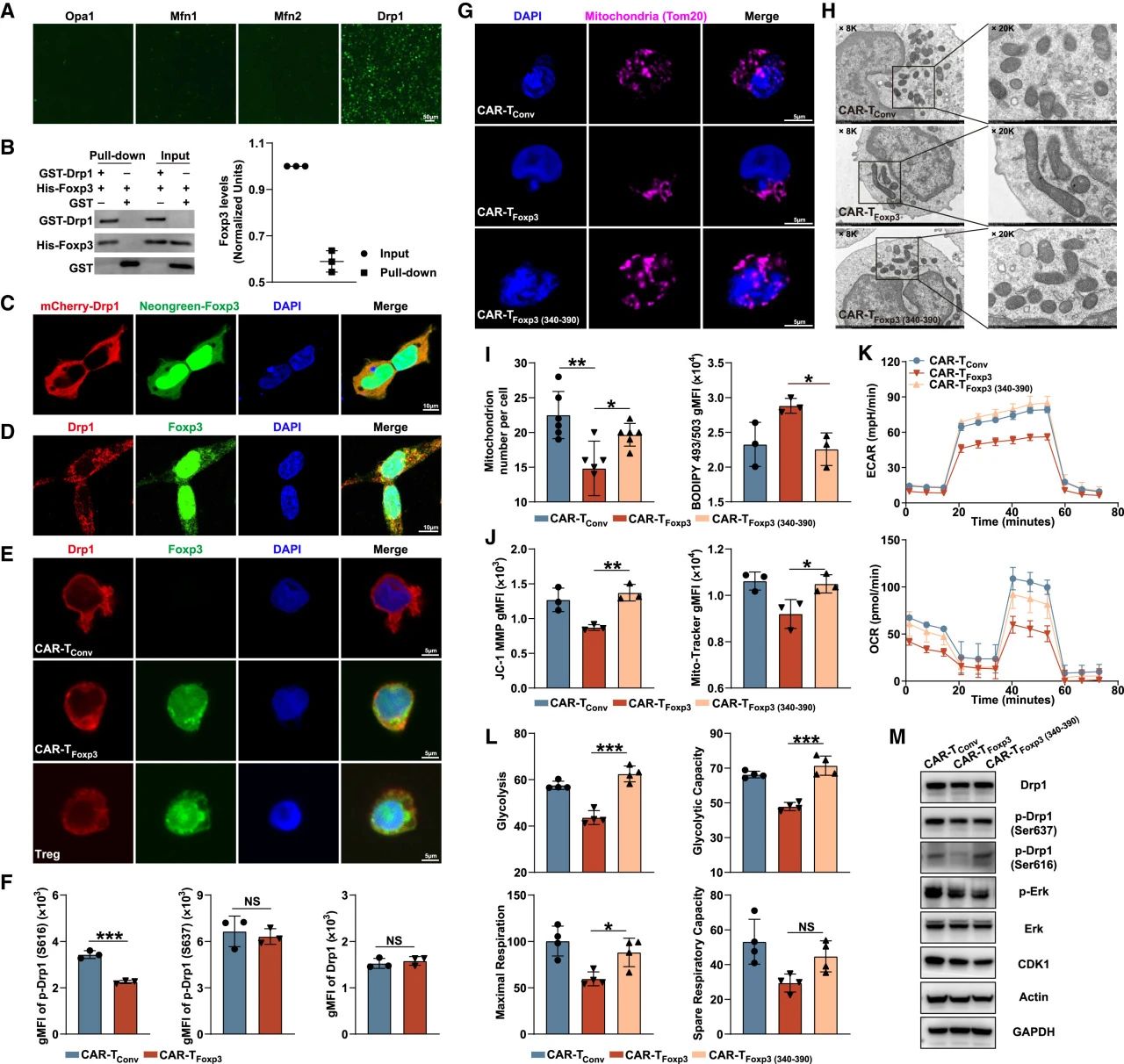
图2. CAR-TFoxp3细胞的代谢特征由Foxp3与Drp1结合决定
三、CAR-TFoxp3细胞无法获得Treg的染色质可及性和抑制功能
ATAC-seq分析显示CAR-TFoxp3细胞的染色质开放区域分布与CAR-TConv相似,与Treg显著不同。Treg特有的开放区域富集免疫抑制相关转录因子结合位点,而CAR-TFoxp3缺乏此特征。
功能上,CAR-TFoxp3细胞分泌IL-10、TGF-β和表达CTLA-4水平极低,且不能抑制T细胞增殖,证明其不具备Treg的抑制功能。少数CAR-TFoxp3与Treg共享的开放区域主要富集于代谢相关通路,其代谢状态改变(如乳酸、NADH下降)可能影响染色质可及性,但核心表观遗传程序和免疫抑制功能未被诱导。
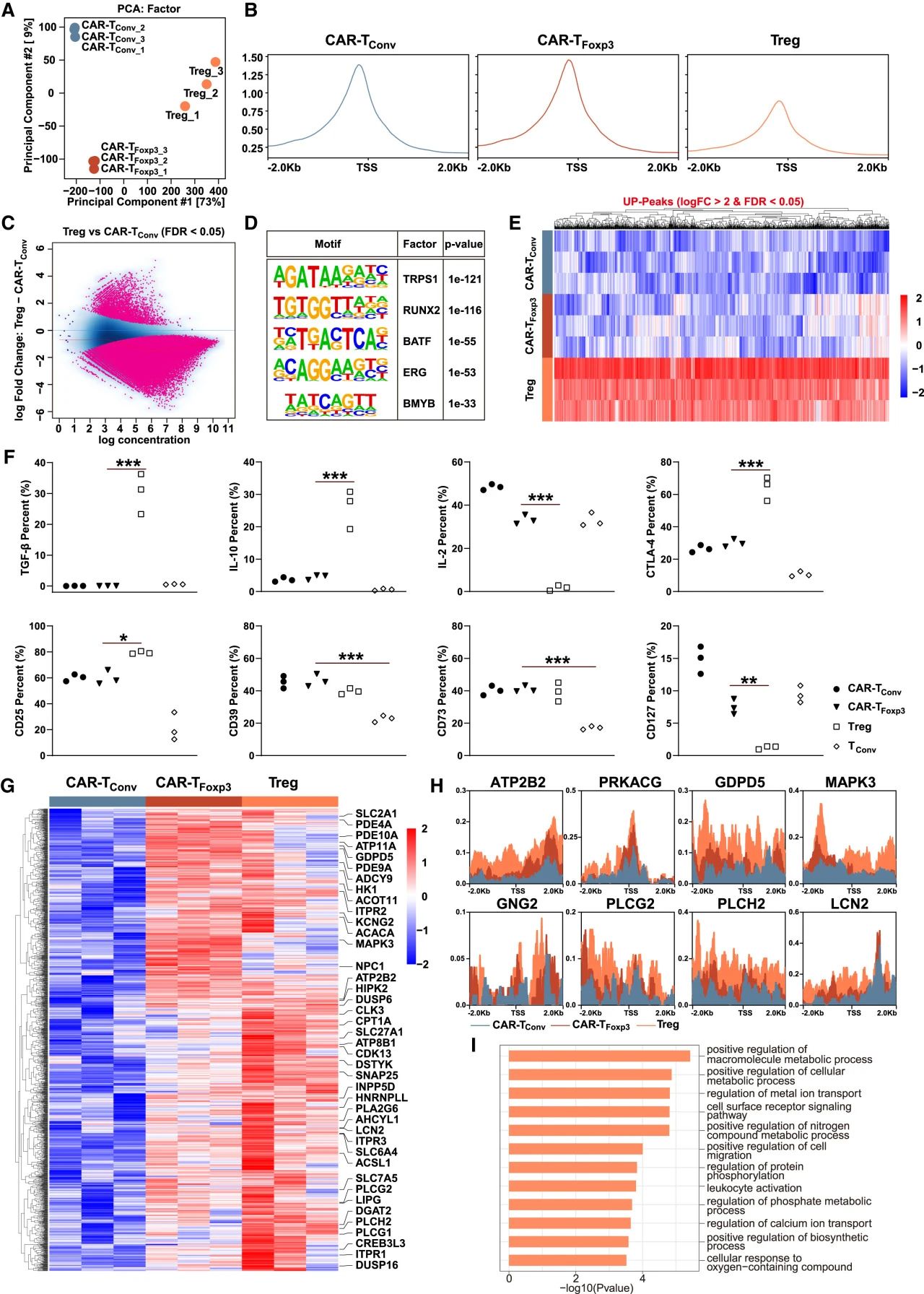
图3. CAR-TFoxp3细胞无法获得 Treg 的染色质可及性和抑制功能
四、Foxp3介导的代谢下调CAR-TFoxp3细胞中衰竭相关抑制分子的表达
与肿瘤细胞共培养时,CAR-TFoxp3细胞高表达CD27、CD28、CD62L、BCL-6等记忆/活化分子,而关键耗竭标志物PD-1、LAG-3、TIM-3的表达显著低于CAR-TConv细胞,且三重/双重阳性细胞比例更低。其细胞毒性与CAR-TConv相当,但效应因子(GZMB, IFN-γ, TNF-α)分泌略低。
经多轮抗原刺激,CAR-TFoxp3细胞增殖更持久且耗竭更轻。若缺失Foxp3的Drp1结合域(340-390)或使用Drp1抑制剂(P110)或抑制脂代谢(DCA),均会逆转其低耗竭表型,证明Foxp3-Drp1互作介导的代谢重编程是其抵抗耗竭的关键。
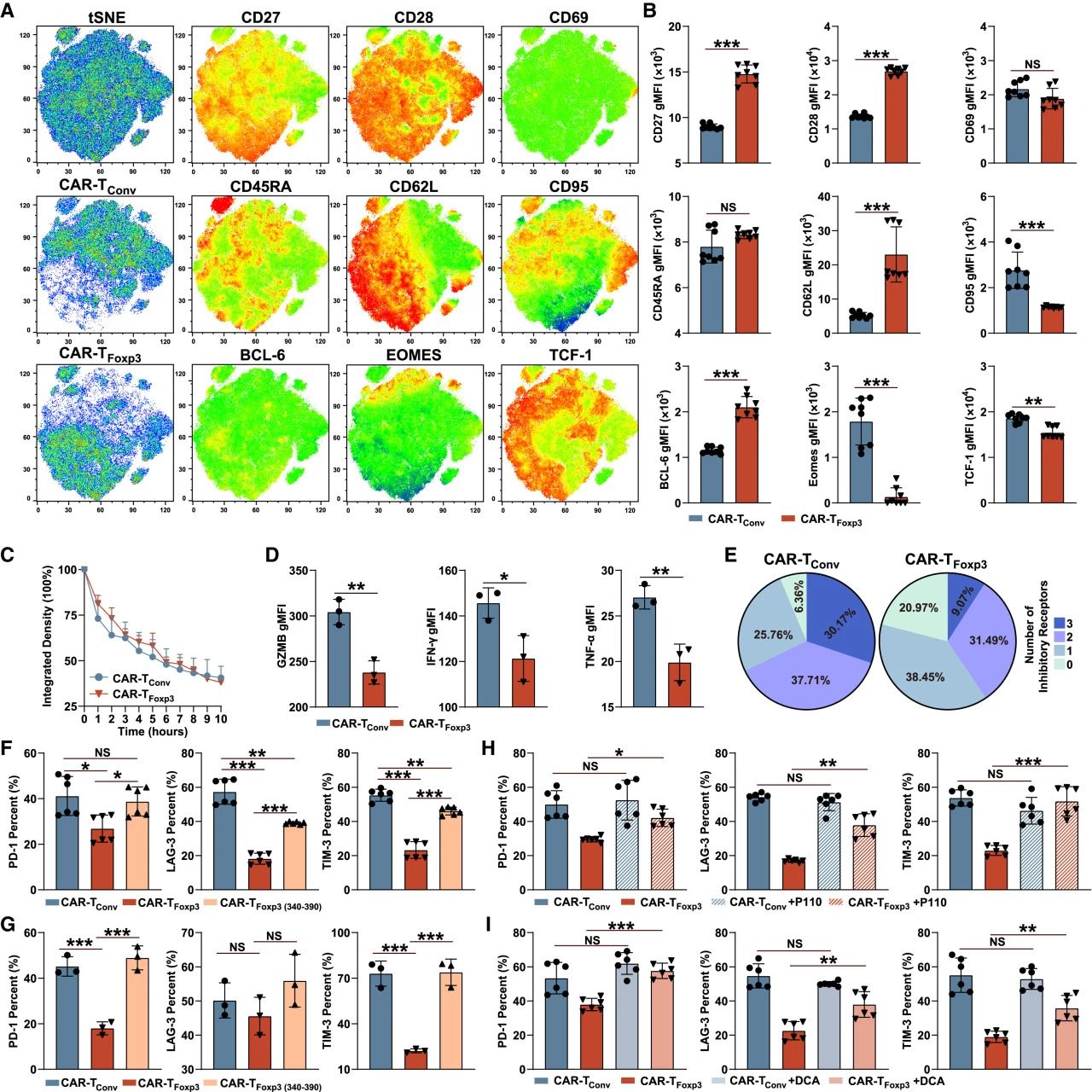
图4. Foxp3介导的代谢下调CAR-TFoxp3细胞中衰竭相关抑制分子的表达
五、CAR-TFoxp3细胞表现出强大的抗肿瘤活性,并降低了体内耗竭标志物
在荷瘤小鼠模型中,CAR-TFoxp3细胞展现出最强的抗肿瘤效果(肿瘤生长最慢、瘤重最低)。瘤内浸润的CAR-TFoxp3细胞持续高表达Foxp3,同时PD-1、LAG-3、TIM-3表达显著下调。
RNA测序显示CAR-TFoxp3细胞耗竭相关基因(TIM-3, LAG-3, EOMES, CXCL13)表达下调,整体处于更低耗竭状态。其转录谱虽与Treg有部分代谢相关基因重叠,但整体差异显著,且富集于线粒体通路,表明其独特表型是Foxp3介导的代谢重编程结果,而非向Treg转化。
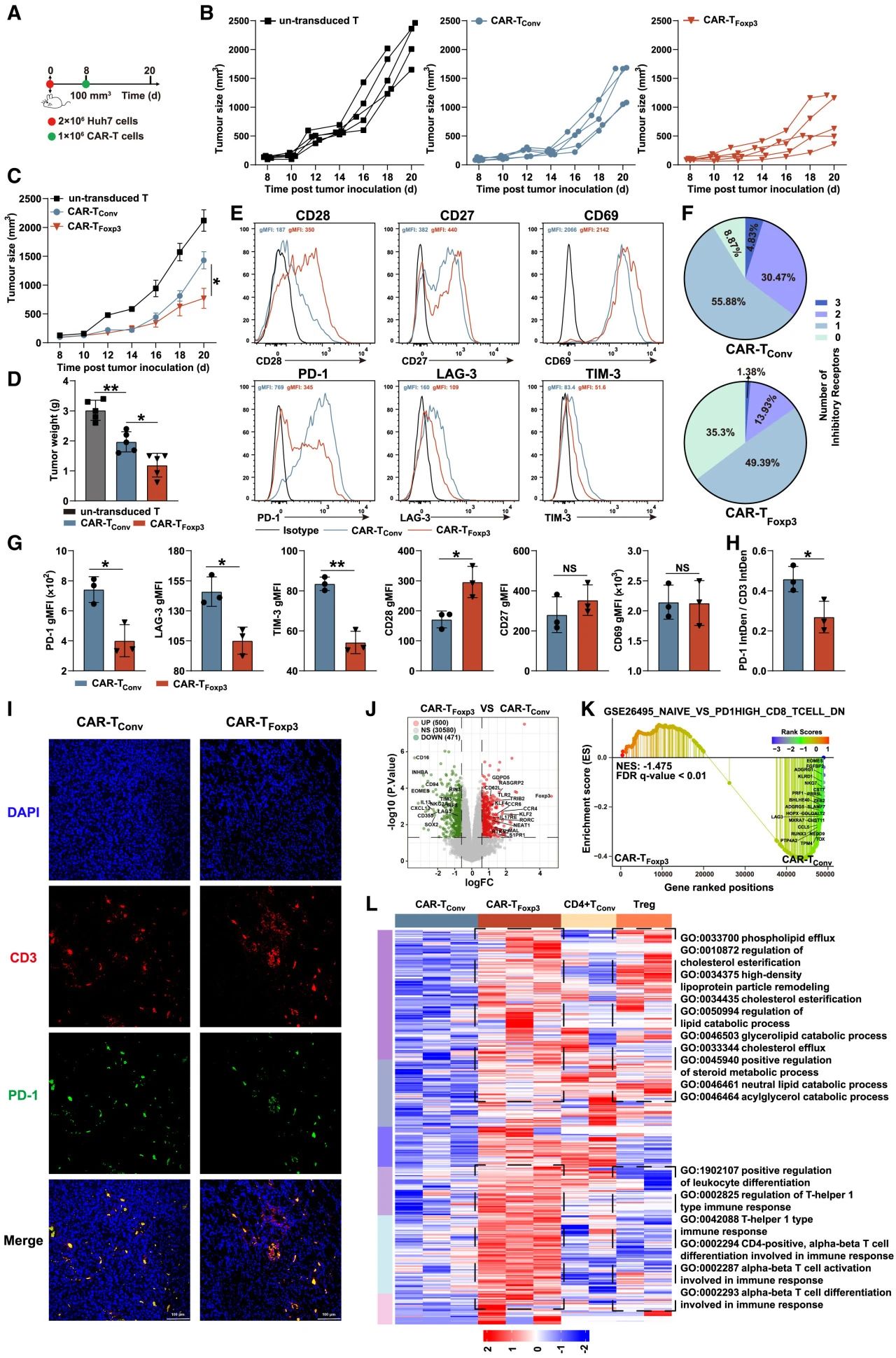
图5. CAR-TFoxp3细胞表现出强大的抗肿瘤活性,并降低了体内耗竭标志物
六、Foxp3在CAR-TFoxp3细胞体内维持持久的抗肿瘤作用和低水平的衰竭标志物
在肿瘤清除后“再挑战”模型中,CAR-TFoxp3组治愈小鼠对二次肿瘤攻击的抵抗力更强(复发更慢)。其外周血中初始/干细胞样记忆T细胞(T_N/T_SCM)比例更高,终末效应细胞(T_EMRA)比例更低。
缺失Foxp3关键结合域(340-390)的CAR-TFoxp3细胞(CAR-TFoxp3(340-390))在再挑战模型中失去了增强的抗肿瘤持久性和低耗竭优势(肿瘤生长速度与CAR-TConv相当,耗竭标志物升高),证实该片段对维持Foxp3赋予的持久抗瘤能力和低耗竭表型至关重要。

图6. Foxp3在CAR-TFoxp3细胞体内维持持久的抗肿瘤作用和低水平的衰竭标志物
七、CAR-TFoxp3细胞在人源化NSG模型中获得强效抗肿瘤活性,但没有获得免疫抑制
在人源化免疫系统(hu-NSG)荷瘤模型中,CAR-TFoxp3细胞展现出显著抗肿瘤活性(部分完全缓解),其瘤内PD-1、LAG-3表达低于CAR-TConv,CD4⁺ T细胞浸润增加。
血清细胞因子分析显示CAR-TFoxp3组TNF-α与IL-10水平显著低于对照组,细胞因子释放更平稳,提示细胞因子风暴风险降低。脾脏及主要器官未见毒性,且免疫细胞组成未显示免疫抑制迹象,证实其在人源背景下兼具强效、安全且无免疫抑制特性。

图7. CAR-TFoxp3细胞在人源化 NSG 模型中获得强效抗肿瘤活性,但没有获得免疫抑制
总 结
该研究发现Foxp3通过其第340-390片段直接结合并抑制线粒体裂变蛋白Drp1(降低Ser616磷酸化),重塑CAR-T细胞代谢:抑制糖酵解与OXPHOS,增强脂代谢。这赋予CAR-TFoxp3细胞在严苛实体瘤微环境中的生存优势和功能持久性。在多种模型(小鼠、人源化)中,CAR-TFoxp3细胞展现出显著增强的抗肿瘤活性、更低的耗竭标志物表达、更高的记忆潜能,且不具备Treg的免疫抑制功能及显著毒性。
总的来说,该研究强调了Foxp3代谢重编程提升CAR-T细胞抗实体瘤治疗疗效,为开发高持久性-低毒性的新型CAR-T疗法提供了理论基础。
代轩生物提供整体课题外包服务
✦ 临床繁忙,没时间没精力 ✦ 文章修回,时间紧内容多 ✦ 条件有限,缺场地缺设备
找代轩生物,一站式医学科研服务平台!
根据客户的既往研究方向,围绕用户的实际需求,结合研究前沿和技术热点,就课题思路的创新性、实验设计的科学性,提供针对性优化指导,提升研究方案的可行性。

代轩生物基于分子、蛋白、生化、流式、病理、细胞、动物、高通量8大实验平台和高水平技术团队,提供实验方面的技术支持,用专业、严谨助力学术成果的产出。
整体课题服务案例(部分示例)
LNCRNA/MIRNA/竞争结合型
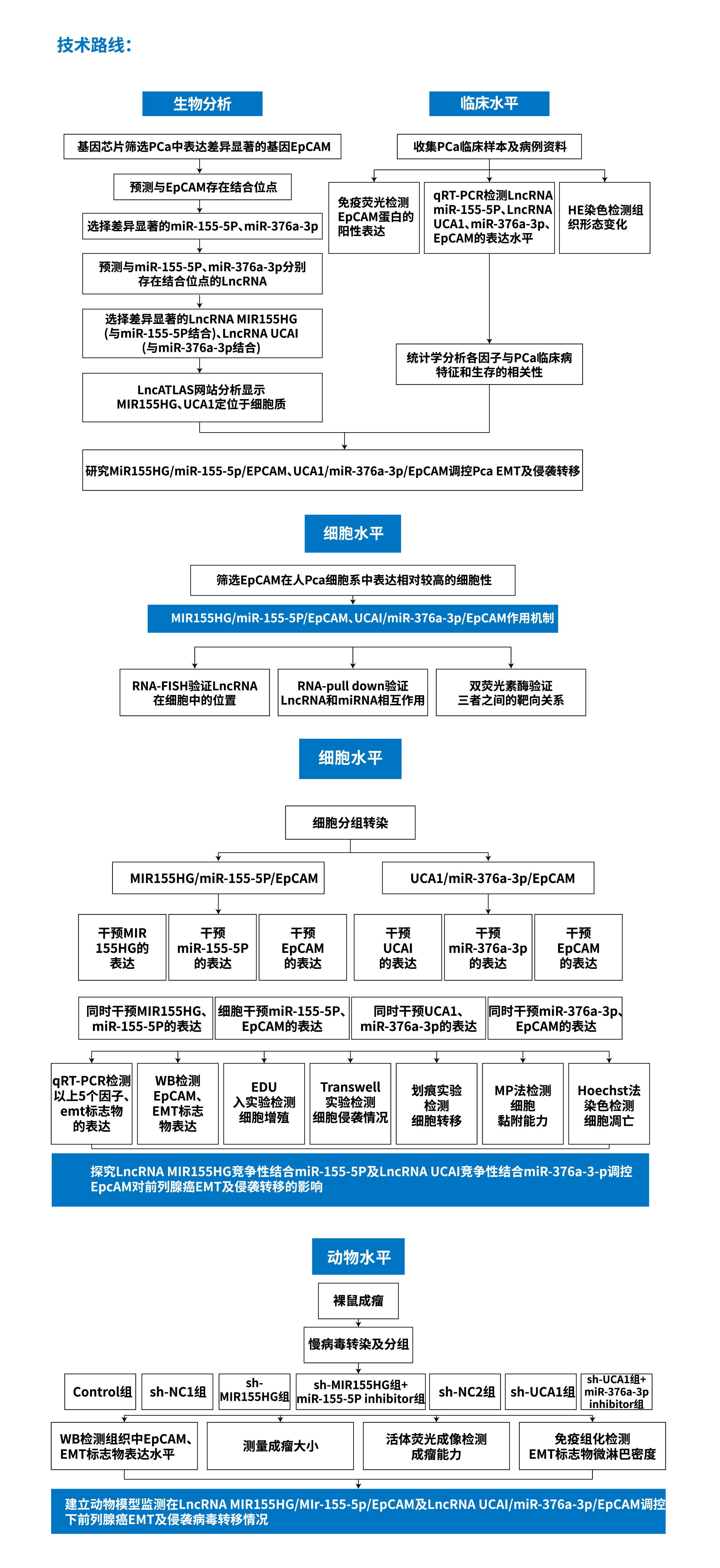 示例A:《LNCRNA MIR155HG和INCRNA UCA1作为CERNA调控EPCAM影响前列腺癌上皮间质转化及侵袭转移的机制研究》
示例A:《LNCRNA MIR155HG和INCRNA UCA1作为CERNA调控EPCAM影响前列腺癌上皮间质转化及侵袭转移的机制研究》
外泌体蛋白/RNA功能研究型

示例B:《间充质干细胞来源外泌体传递MIR-146A对脓毒症血管平滑肌线粒体功能障碍作用机制》
MICRORNA靶向调控型
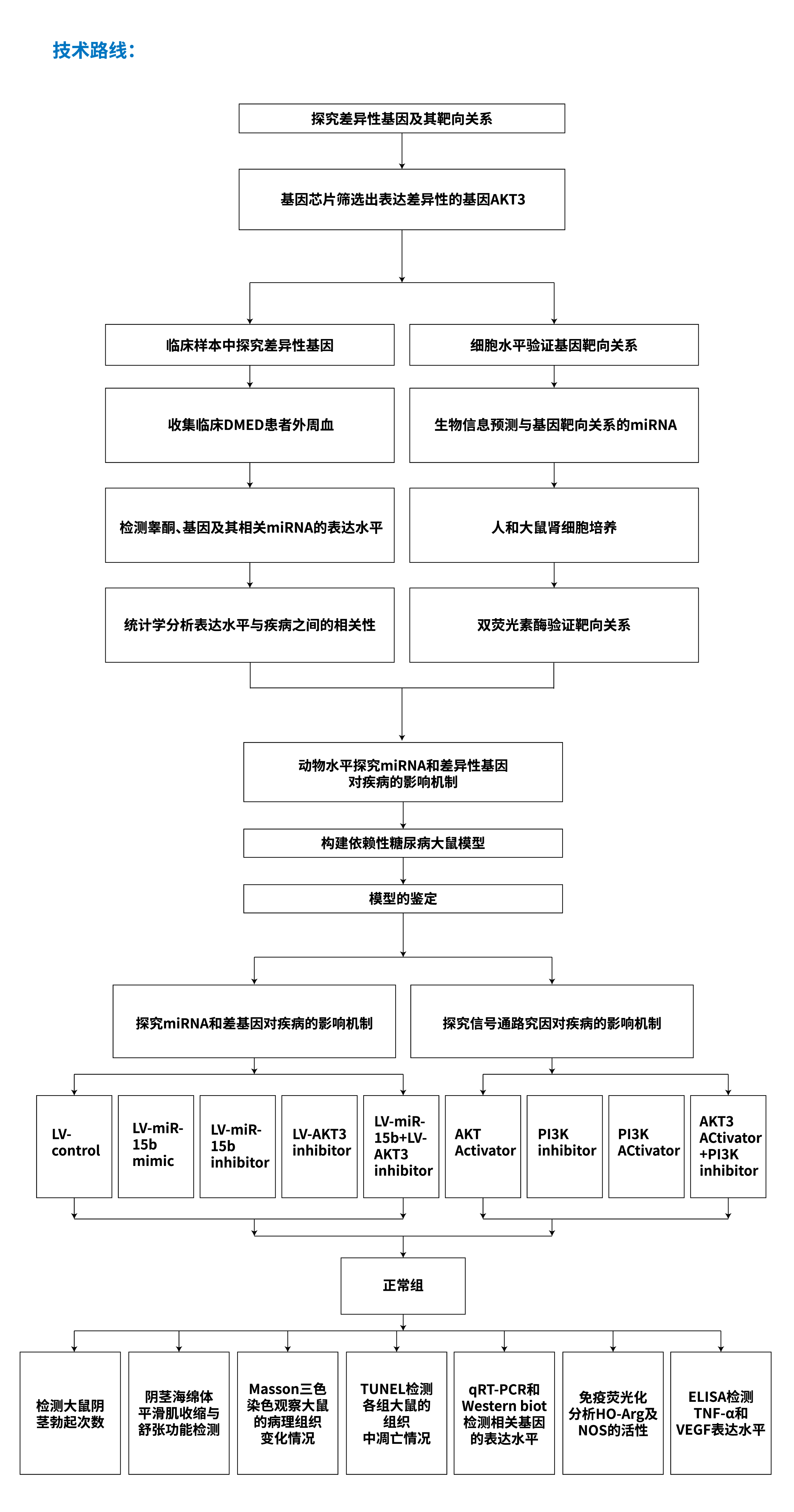
示例C:《MICRORNA-15B调控AKT3对大鼠糖尿病勃起功能障碍的影响》
合作单位(部分)




