动脉粥样硬化调控新发现:胡庆华教授团队揭示P2Y6R的关键作用机制
巨噬细胞衍生的泡沫细胞在动脉粥样硬化的发病机制中发挥着因果作用。既往研究已发现嘌呤能受体P2Y6R在病变部位的高表达与动脉粥样硬化形成密切相关,被视为一个重要的致病因子,然而其调控泡沫细胞形成的具体机制一直未被阐明。
针对这一关键科学问题,中国药科大学胡庆华教授团队在心血管领域顶级期刊《European Heart Journal》上发表了重要研究成果:“Macrophage P2Y6 receptor deletion attenuates atherosclerosis by limiting foam cell formation through phospholipase Cβ/store-operated calcium entry/calreticulin/scavenger receptor A pathways”(IF=37.6)。

该研究验证发现:巨噬细胞P2Y6R的缺失通过减少磷脂酶Cβ/钙库操作的钙进入途径介导的清道夫受体A表达,显著抑制氧化低密度脂蛋白的摄取。通过重新利用药物库进行高通量Glide对接,研究者发现焦磷酸硫胺素是一种有效的P2Y6R拮抗剂,具有优异的P2Y6R拮抗活性和结合亲和力,并验证了其抗动脉粥样硬化作用。
这项研究不仅确证了P2Y6R的致病作用,更系统解析了其下游信号通路,为理解动脉粥样硬化发病机理提供了新视角,也为开发靶向P2Y6R或该信号通路的新型抗动脉粥样硬化药物奠定了重要的基础。
文献 / 研究结果
研究结果 01——P2Y6R缺失可抑制动脉粥样硬化进展
为阐明 P2Y6R 在动脉粥样硬化(AS)中的作用,研究整合分析了人类动脉粥样硬化斑块(GSE23314, GSE100927, GSE43292)及患者外周血(GSE12288)的 RNA-seq 数据。结果显示,AS 斑块和患者外周血中 P2Y6R mRNA 表达均显著上调。此发现在高脂喂养的 LDLR−/− 小鼠主动脉的 qRT-PCR 分析中得到验证。关键的是,与对照组相比,P2Y6R 基因缺失显著减少了 AS 小鼠模型的主动脉斑块面积(通过主动脉弓、全长油红染色及根部油红/HE 染色评估)和脂质蓄积。
结论:P2Y6R 缺失可有效抑制动脉粥样硬化进展。

图1 图片来源于European Heart Journal网站
研究结果 02——巨噬细胞特异性P2Y6R缺失可缓解动脉粥样硬化形成
为确定关键细胞,研究分析了健康与动脉粥样硬化(AS)血管单细胞 RNA-seq 数据(GSE196395)。结果显示 P2Y6R 在巨噬细胞中高表达,且在 AS 病变巨噬细胞中表达显著上调。
为进一步验证巨噬细胞 P2Y6R 对动脉粥样硬化形成的影响,该研究构建了 LDLR−/−P2Y6Rfl/fl LysMcre小鼠,并在高脂喂养12周后与对照小鼠进行分析比较。结果显示,高脂喂养的小鼠主动脉弓斑块面积和脂质蓄积较对照组(LDLR−/−P2Y6Rfl/fl)显著减少。
此外,该研究还构建了骨髓移植小鼠,并进一步证实:将 P2Y6R 缺陷骨髓(LDLR−/−P2Y6R−/−)移植入 LDLR−/−受体小鼠,其斑块面积和脂质蓄积显著少于移植野生型(LDLR−/−)骨髓组。组织学分析(HE/油红染色)一致显示受体或供体骨髓缺乏 P2Y6R 均能减少脂质沉积。
结论:巨噬细胞 P2Y6R 表达促进 AS 斑块形成,是潜在治疗靶点。

图2 图片来源于European Heart Journal网站
研究结果 03——巨噬细胞P2Y6R缺失可减少清道夫受体A(SR-A)介导的泡沫细胞形成
研究进一步探讨 P2Y6R 是否影响巨噬细胞泡沫化——动脉粥样硬化进展的关键环节。
结果显示:
1)抑制泡沫化: P2Y6R 缺失(小鼠 BMDM 或沉默 P2Y6R 的 THP-1 细胞)显著减少脂质蓄积(油红 O 染色)并降低对 oxLDL 的摄取。
2)靶向调控 SR-A: 巨噬细胞通过清道夫受体(如 CD36、SR-A、LOX-1)摄取修饰脂蛋白(如 oxLDL)。研究发现,在 oxLDL 刺激下,P2Y6R 缺失特异性下调 SR-A 蛋白表达(小鼠 BMDM 及 THP-1 细胞),但对 CD36 或 LOX-1 无显著影响(图 3E,F)。
结论:P2Y6R 通过下调 SR-A 受体表达,降低了巨噬细胞对 oxLDL 的摄取和泡沫细胞形成(图 3)。
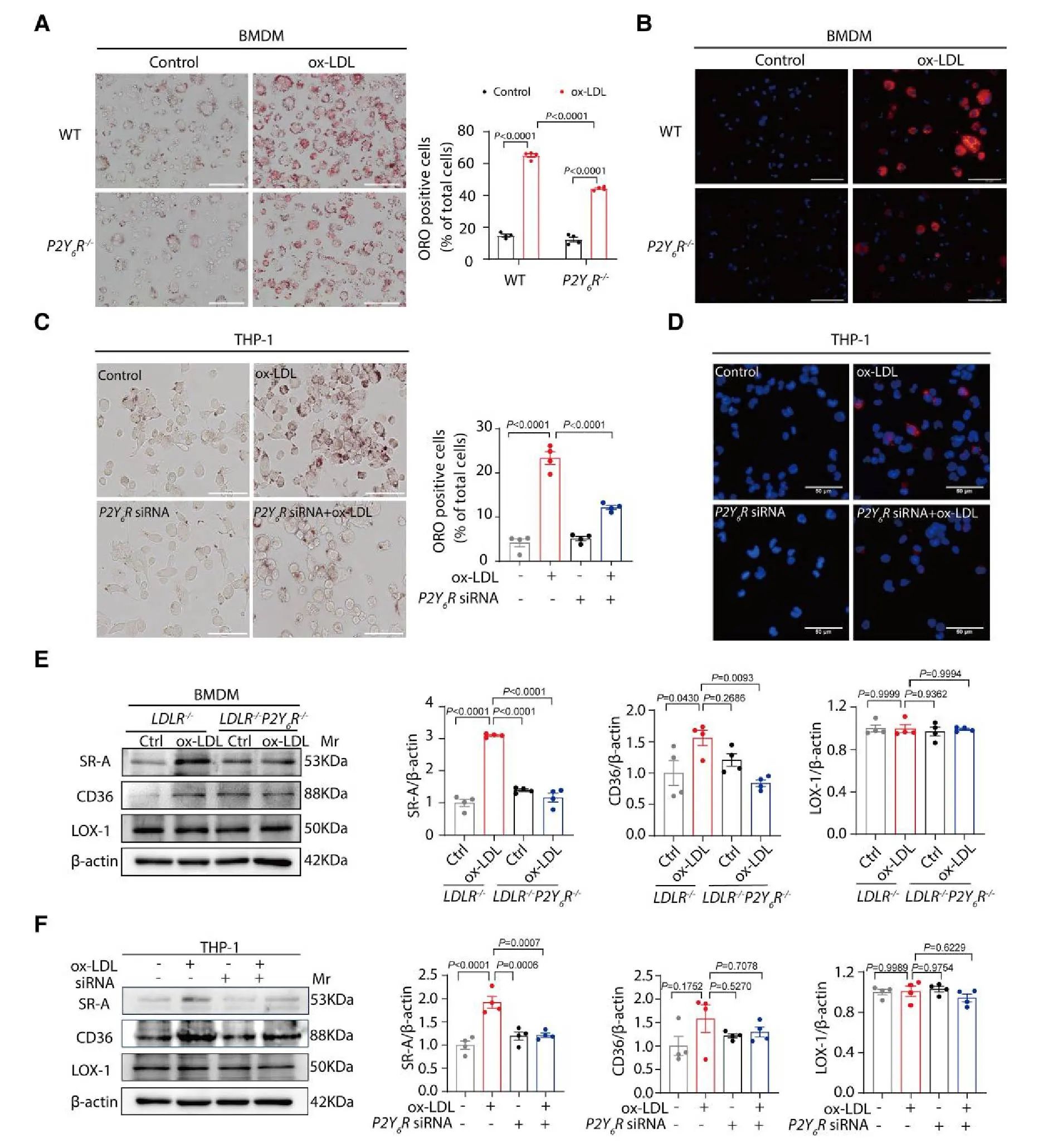
图3 图片来源于European Heart Journal网站
研究结果 04——巨噬细胞P2Y6R介导钙信号通路的激活
为阐明 P2Y6R 调控巨噬细胞泡沫化的机制,研究对 ox-LDL 刺激的 LDLR−/− 和 LDLR−/−P2Y6R−/− 小鼠 BMDM 进行 RNA-seq,鉴定出 487 个差异基因(DEGs)。KEGG 分析显示 DEGs 显著富集于钙信号通路。
关键验证:
1)钙信号激活: ox-LDL 刺激显著升高 THP-1 细胞内 Ca2+ ([Ca²⁺]i) 的浓度,此效应被 P2Y6R 沉默抑制 (图 4D)。
2)钙源解析: ox-LDL 在无钙介质中引起短暂 [Ca²⁺]i 升高(储存钙释放),随后添加外钙(2mM)引发持续 [Ca²⁺]i 升高(外钙内流);P2Y6R 沉默部分抑制后者 (图 4E)。
3)上游机制: 已知 P2Y6R 偶联 Gq 激活 PLCβ。实验证实,P2Y6R 缺失显著降低 BMDM (图 4F)、ox-LDL 刺激的 THP-1 细胞 (图 4G) 及小鼠主动脉斑块巨噬细胞 (图 4H) 中 PLCβ 蛋白表达。
结论: P2Y6R 缺失通过下调 PLCβ,抑制钙信号(特别是外钙内流),从而调控泡沫化相关基因表达 (图 4)。

图4 图片来源于European Heart Journal网站
为验证通路作用,研究在 P2Y6R 过表达 (P2Y6R-OE) THP-1 细胞中使用 PLCβ 抑制剂 U73122 或钙螯合剂 BAPTA-AM。
结果显示:
1)抑制表型: U73122 或 BAPTA-AM 消除了 P2Y6R-OE 引起的脂滴累积、脂质摄取增加和胞内 Ca²⁺ 上调 (图 5A-E)。
2)抑制靶点: 两者也降低了 P2Y6R-OE 诱导的 SR-A 蛋白升高 (图 5F)。
结论: P2Y6R 通过 PLCβ-Ca²⁺ 信号通路介导 SR-A 表达及泡沫细胞形成 (图 5)。
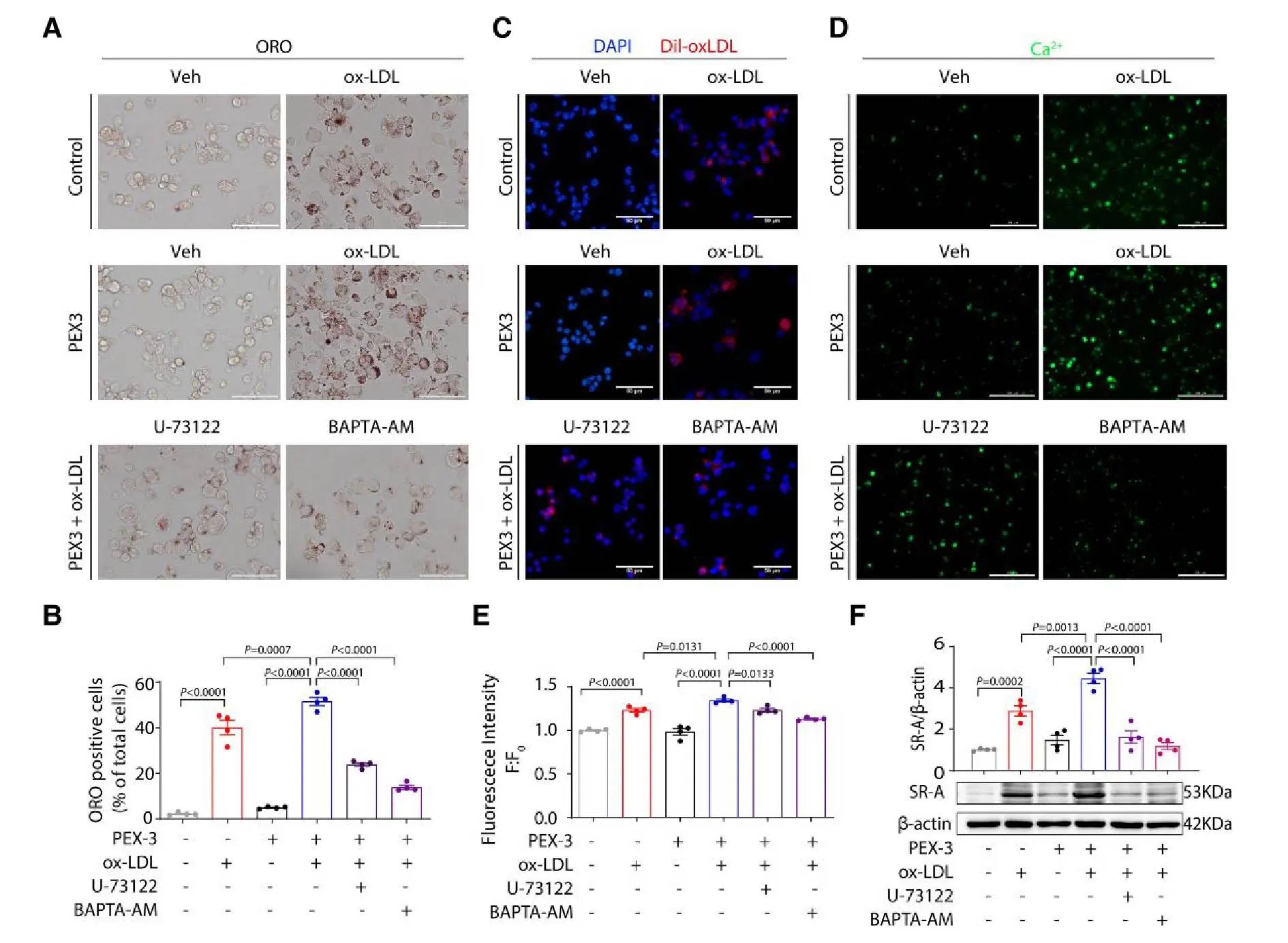
图5 图片来源于European Heart Journal网站
研究结果 05——STIM1/ORAI1信号调节巨噬细胞中泡沫细胞的形成
鉴于钙库介导的钙内流 (SOCE) 由 STIM1-ORAI1 偶联介导,且受 PLCβ 上游调控,研究探讨了 P2Y6R 对 STIM1-ORAI1 的作用。
关键发现:
1)调控 STIM1-ORAI1 偶联:
-
免疫共沉淀显示沉默 P2Y6R 抑制 STIM1-ORAI1 相互作用。
-
在 P2Y6R-OE 细胞中,U73122 或 BAPTA-AM 降低 STIM1-ORAI1 复合表达。
-
LDLR−/−P2Y6R−/− 小鼠主动脉根部巨噬细胞 (F4-80⁺) 的 STIM1 和 ORAI1 表达显著低于 LDLR−/− 小鼠。
2)抑制 SOCE 阻断泡沫化: 使用 SOCE 抑制剂 BTP2:
-
消除 STIM1-ORAI1 相互作用 (图 6E)。
-
抑制脂滴积累 (图 6F)、脂质摄取 (图 6G,H)、胞内 Ca²⁺ 上调 (图 6I,J) 和 SR-A 蛋白表达 (图 6K)。
结论: P2Y6R 通过 PLCβ 激活 STIM1/ORAI1 介导的 SOCE,驱动 Ca²⁺ 信号、SR-A 表达及巨噬细胞泡沫化 (图 6)。

图6 图片来源于European Heart Journal网站
研究结果 06——P2Y6R促进钙网织蛋白与SR-A的相互作用
为阐明 STIM1/ORAI1 如何调控 SR-A 表达,研究采用 DNA Pull-down(生物素标记 SR-A 探针)结合蛋白质组学分析 ox-LDL 刺激的 LDLR−/− 和 LDLR−/−P2Y6R−/− 小鼠 BMDM(分四组:LO, LPO, LC, LPC)。
核心发现:
1)鉴定关键调控蛋白: 共鉴定 183 种与 SR-A (Msr1) 相互作用的蛋白。与 P2Y6R 缺失组 (LPO) 相比,野生型+oxLDL 组 (LO) 显著差异表达 52 种蛋白(47↑, 5↓)。富集分析显示这些蛋白(含 SR-A)显著关联“对脂质的反应”、“内质网蛋白加工”和“A类清道夫受体”等通路。
2)锁定枢纽蛋白 CALR: CALR 被识别为参与上述关键通路的核心调控枢纽。
3)验证三元互作: 在 LDLR−/− BMDM 中:
-
STIM1-CALR 复合物减少
-
CALR-SR-A 复合物增加
-
P2Y6R 缺失则相反:增强 STIM1-CALR 互作,减弱 CALR-SR-A 互作 (图 7D)。免疫荧光染色结果一致 (图 7E-H)。
结论: P2Y6R 通过调节 STIM1/CALR 轴的相互作用,影响 CALR 与 SR-A 的结合,从而调控 SR-A 表达 (图 7)。
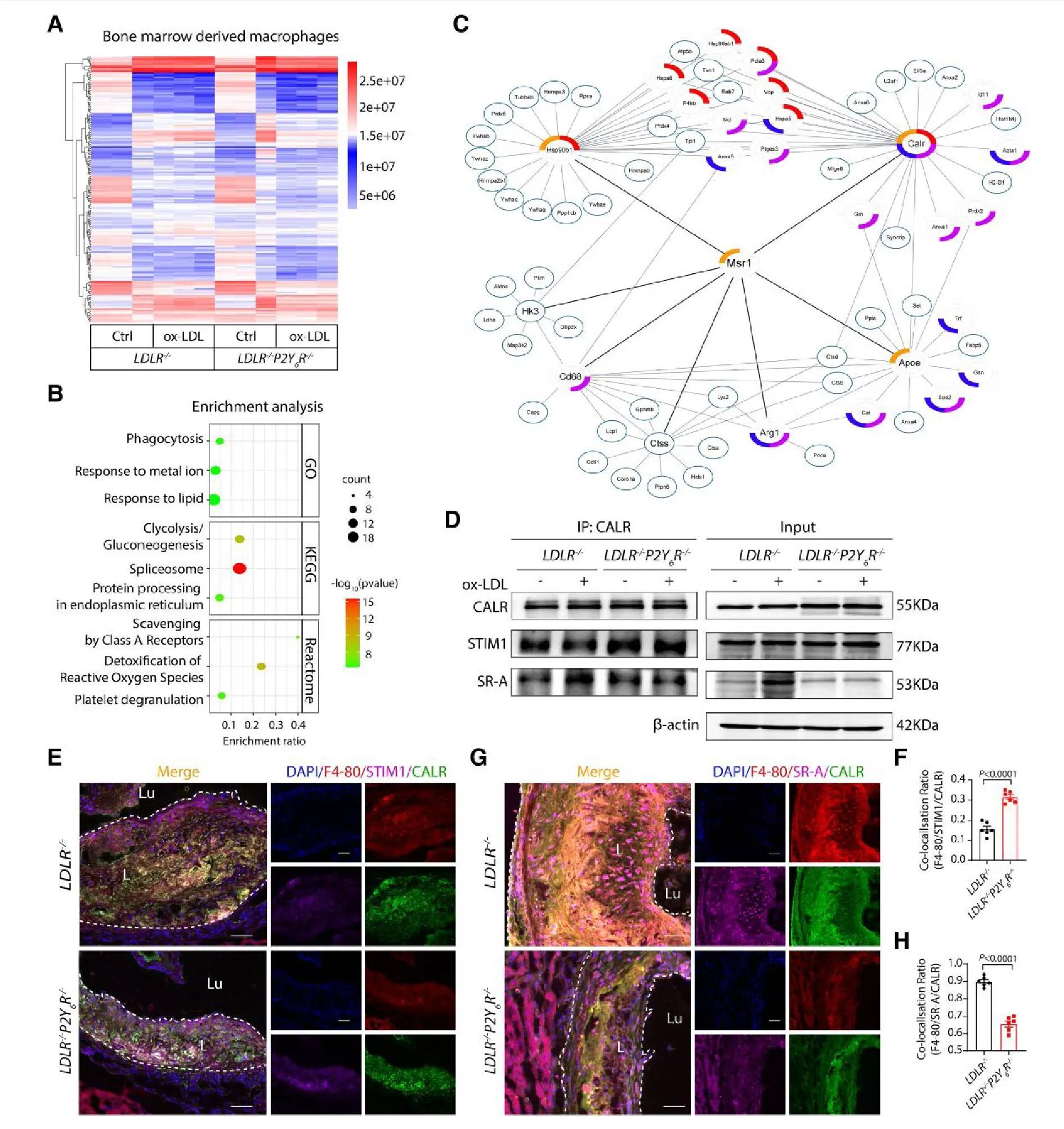
图7 图片来源于European Heart Journal网站
研究结果 07——抑制P2Y6R是减轻动脉粥样硬化的潜在治疗途径
基于 P2Y6R 在巨噬细胞泡沫化中的关键作用,研究筛选老药库鉴定出焦磷酸硫胺素 (TPP) 为强效 P2Y6R 拮抗剂(优于磷酸吡哆醛)。TPP 有效抑制 HEK293-hP2Y6R 细胞中 UDP (10μM) 升高的 PLCβ 和 P2Y6R 表达。分子对接显示 TPP 与 P2Y6R 关键残基结合 (图 8B),细胞热位移实验证实其靶向结合能力。
关键药效与机制验证:
1)体外: TPP (10μM) 直接抑制巨噬细胞脂质蓄积和摄取。其作用不受丙酮酸脱氢酶抑制剂 Devimistat 影响,且在 P2Y6R−/− BMDM 中失效 (图 8I,J),证明其通过 P2Y6R 起效。
2)体内: 高脂喂养 LDLR−/− 小鼠给予 TPP (20/40 mg/kg/day, 第5周起) 12 周后,斑块面积和脂质蓄积呈剂量依赖性显著减少。
3)靶点特异性: 在巨噬细胞特异性 P2Y6R 敲除小鼠 (LDLR−/−P2Y6Rfl/fl LysMcre) 中,TPP 未显示出额外保护作用 (图 8K-M),进一步确认其靶向巨噬细胞 P2Y6R。
4)安全性: TPP 对小鼠体重、摄食量、主要器官系数、肝肾功能指标 (ALT, AST, BUN, Cr) 及器官组织学 (HE染色) 均无显著不良影响。
结论: TPP 作为高效、特异的 P2Y6R 拮抗剂,通过阻断巨噬细胞泡沫化显著减轻动脉粥样硬化,且安全性良好,为 AS 治疗提供了新策略。
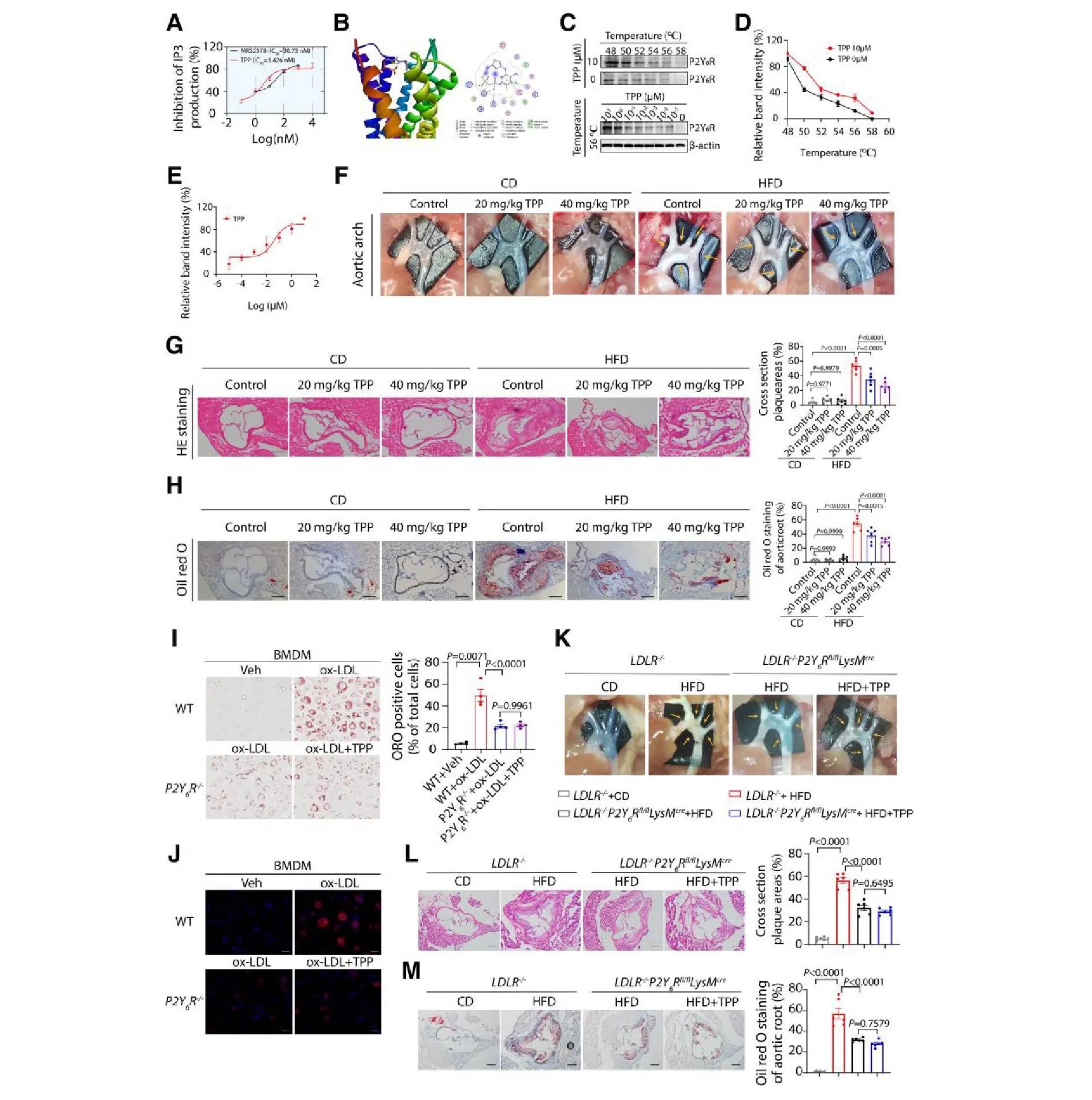
图8 图片来源于European Heart Journal网站
总结:P2Y6R 通过激活“PLCβ/SOCE/CALR 信号轴”上调 SR-A 蛋白表达,促进巨噬细胞摄取脂蛋白及泡沫化,驱动动脉粥样硬化(AS)。靶向拮抗 P2Y6R 是缓解 AS 的关键途径。焦磷酸硫胺素(TPP)被鉴定为新型 P2Y6R 拮抗剂,其抑制泡沫化及 AS 的作用超出其生理代谢功能,且特异性依赖 P2Y6R 靶点。TPP 安全性良好,具备开发为临床抗 AS 候选药物或保健品的潜力,尤其适用于高危人群预防。
代轩生物提供整体课题外包服务
✦ 临床繁忙,没时间没精力 ✦ 文章修回,时间紧内容多 ✦ 条件有限,缺场地缺设备
找代轩生物,一站式医学科研服务平台!
根据客户的既往研究方向,围绕用户的实际需求,结合研究前沿和技术热点,就课题思路的创新性、实验设计的科学性,提供针对性优化指导,提升研究方案的可行性。

代轩生物基于分子、蛋白、生化、流式、病理、细胞、动物、高通量8大实验平台和高水平技术团队,提供实验方面的技术支持,用专业、严谨助力学术成果的产出。
整体课题服务案例(部分示例)
LNCRNA/MIRNA/竞争结合型
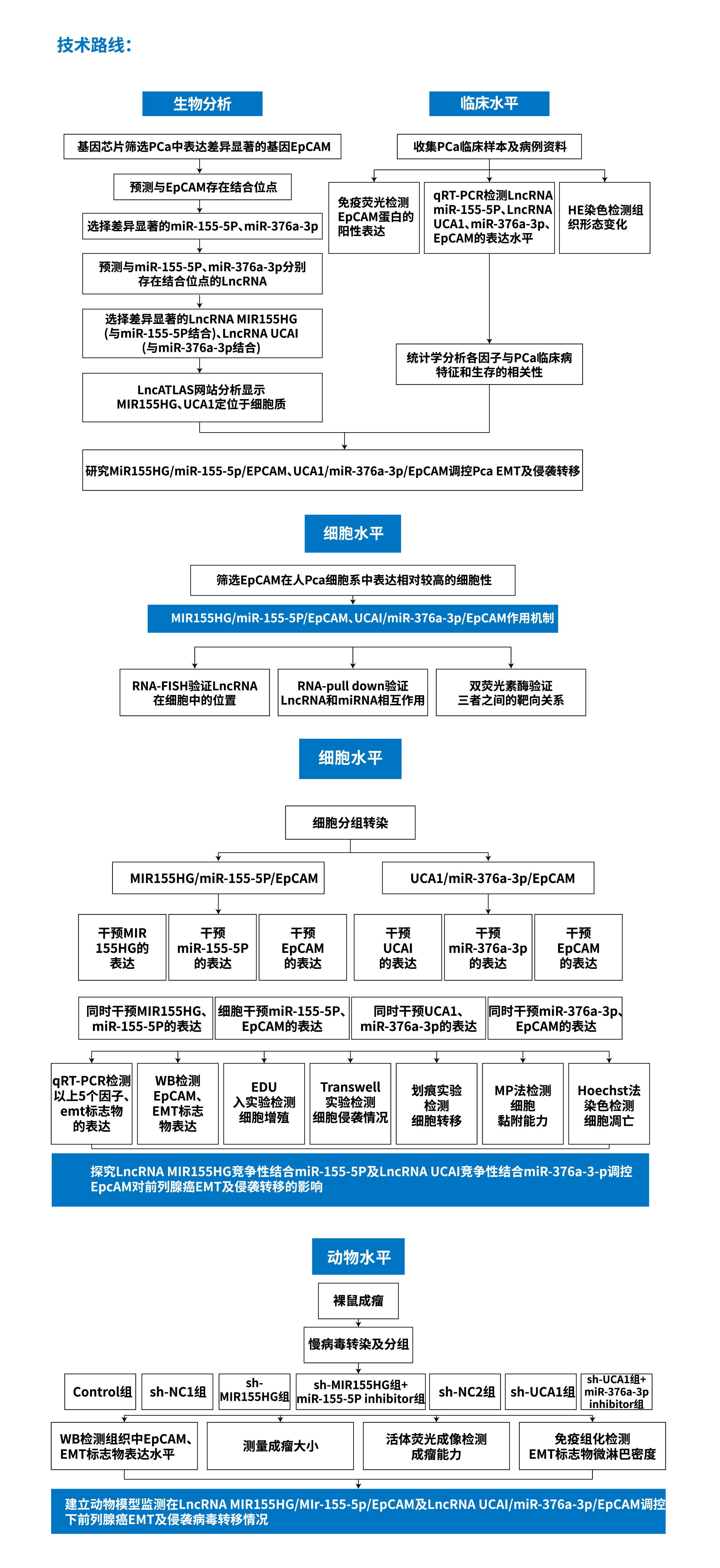 示例A:《LNCRNA MIR155HG和INCRNA UCA1作为CERNA调控EPCAM影响前列腺癌上皮间质转化及侵袭转移的机制研究》
示例A:《LNCRNA MIR155HG和INCRNA UCA1作为CERNA调控EPCAM影响前列腺癌上皮间质转化及侵袭转移的机制研究》
外泌体蛋白/RNA功能研究型

示例B:《间充质干细胞来源外泌体传递MIR-146A对脓毒症血管平滑肌线粒体功能障碍作用机制》
MICRORNA靶向调控型
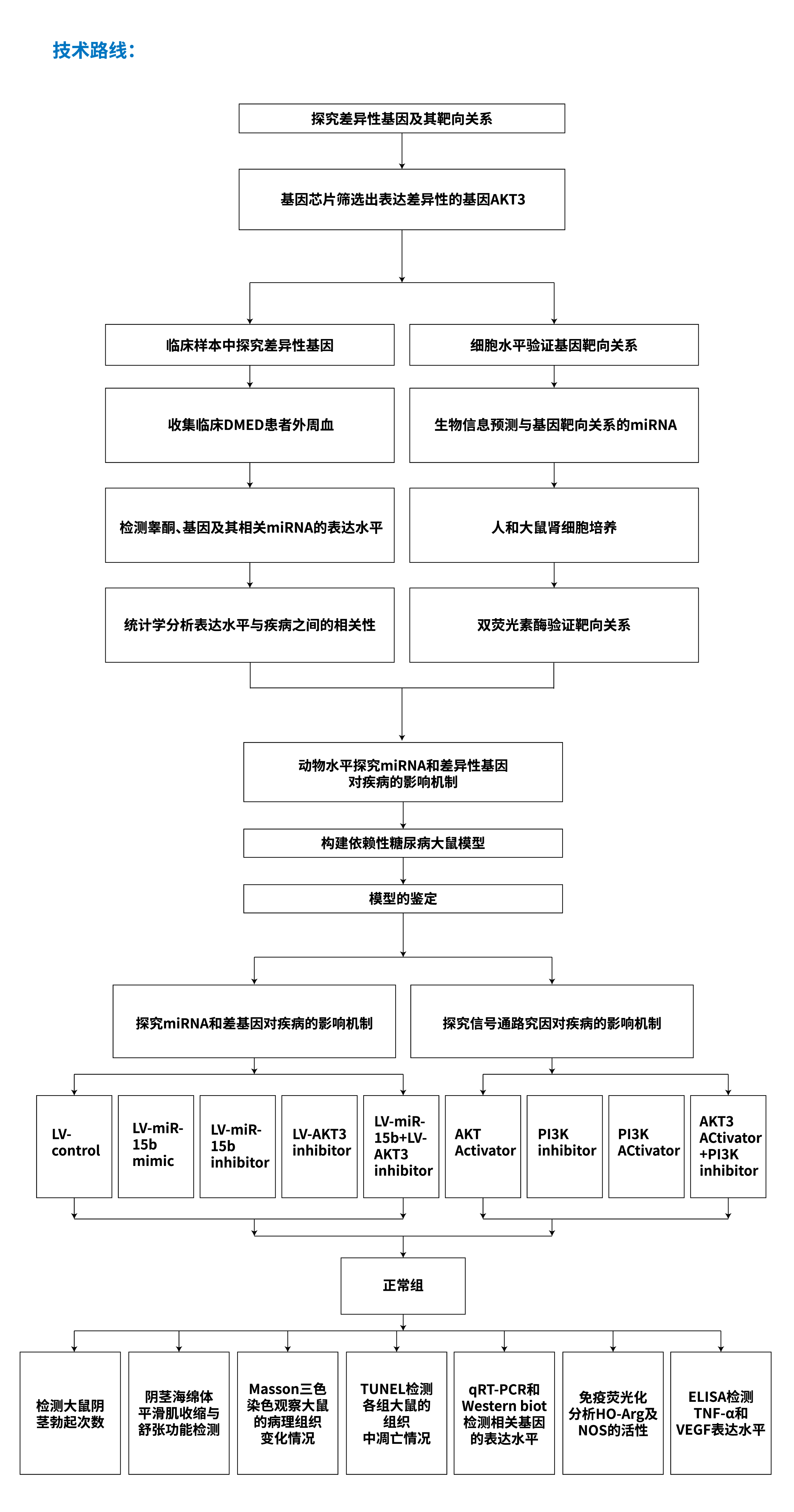
示例C:《MICRORNA-15B调控AKT3对大鼠糖尿病勃起功能障碍的影响》
合作单位(部分)




